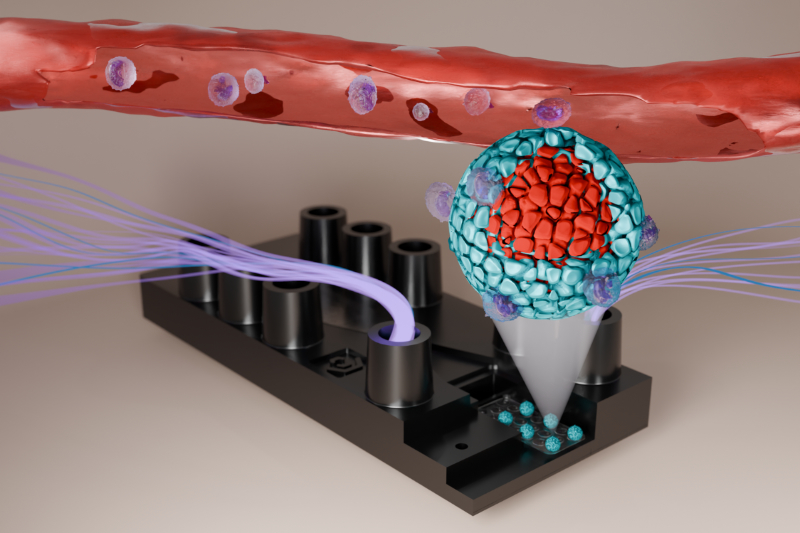
Jährlich erhalten weltweit rund eine halbe Million Menschen die Diagnose Bauchspeicheldrüsenkrebs, darunter mehr als 20.000 in Deutschland. Diese Zahlen verdeutlichen die Dringlichkeit der Suche nach wirksamen Therapien. Besonders das duktale Pankreas-Adenokarzinom (PDAC) stellt aufgrund seiner ausgeprägten Widerstandsfähigkeit, vor allem verursacht durch seine komplexe Tumormikroumgebung, gegenüber herkömmlichen Therapien eine enorme Herausforderung dar. Um neue Therapieansätze gezielt zu erforschen, sind bessere Modelle der Tumorbiologie erforderlich. Hier setzt der Tumor-on-Chip an, der die Mikroumgebung des PDAC realitätsnah nachbildet. Auf diesem Chip interagieren Krebszellen, Immunzellen und umgebendes Gewebe ähnlich wie im menschlichen Körper. Untersuchungen zeigen zudem, dass Immunzellen in den künstlichen Tumor einwandern und sich zu spezifischen Zelltypen entwickeln, die für Bauchspeicheldrüsenkrebs charakteristisch sind. Dadurch eröffnet das Modell neue Möglichkeiten, um Medikamente effektiver zu testen und die Mechanismen der Tumor-entwicklung besser zu verstehen.
Neue Perspektiven in der Krebstherapie
Das Tumor-on-Chip-Modell bietet einen entscheidenden Vorteil: Es ermöglicht die gezielte und kontrollierte Verabreichung von Arzneimitteln. In der Studie wurde das bereits von der Food and Drug Administration (FDA) zugelassene Medikament Vorinostat auf seine Wirksamkeit gegen Bauchspeicheldrüsenkrebs untersucht. Dabei zeigte sich: Der Wirkstoff konnte die Krebszellen deutlich reduzieren, während gesunde Gefäßzellen unbeschadet blieben. Die Grundlage für diesen Erfolg sind sogenannte PDAC-Sphäroide – winzige, dreidimensionale Tumorstrukturen, die die Realität im Körper besser nachbilden als herkömmliche zweidimensionale Zellkulturen. Daher werden sie in der Krebsforschung genutzt, um die Wirkung von Medikamenten unter möglichst realistischen Bedingungen zu testen. Die Studie zeigt nicht nur das Potenzial von Vorinostat als möglichen Therapieansatz für Bauchspeicheldrüsenkrebs, sondern unterstreicht auch die hohe Aussagekraft des Tumor-on-Chip-Modells für präklinische Tests. Diese Technologie könnte wesentlich zur Entwicklung wirksamerer Therapien beitragen und langfristig die Überlebenschancen von Patientinnen und Patienten verbessern.
Das entwickelte Modell ist Teil der Organ-on-Chip-Technologie von Dynamic42, die darauf ausgelegt ist, menschliche Organe in Miniaturform nachzubilden. Diese originellen Systeme nutzen mikroskopisch kleine Kanäle, die dünner als ein menschliches Haar sind, um Flüssigkeiten auf winzigstem Raum präzise zu steuern. Durch die Kombination von lebenden Zellen mit mikrofluidischen Systemen entsteht eine realitätsnahe Umgebung, die eine präzisere Erforschung von Krankheitsmechanismen und Wirkstoffen ermöglicht.
„Dieses wegweisende Modell stellt einen bedeutenden Schritt in der präklinischen Krebsforschung dar. Es erlaubt uns, die komplexen Vorgänge innerhalb der Tumormikroumgebung genau zu untersuchen und somit die Entwicklung innovativer Therapieansätze deutlich zu beschleunigen“, betont Dr. Martin Raasch, CEO und Gründer von Dynamic42.
„Dank der Zusammenarbeit mit Dynamic42 konnten wir ein fortschrittliches System entwickeln, das die Forschung im Bereich Bauchspeicheldrüsenkrebs erheblich voranbringen wird. Wir sind zuversichtlich, dass dieses Modell eine Schlüsselrolle bei der Entstehung neuer Behandlungsmöglichkeiten spielen wird“, ergänzt Prof. Dr. Nicole Teusch, Leiterin des Instituts für Pharmazeutische Biologie und Biotechnologie an der Heinrich-Heine-Universität.