Aktuelle Umfrage: Deutsche vertrauen Ärzten bei der Entscheidung
zwischen Originalpräparat und Biosimilar
– Deutsche sind offen für Innovationen, aber skeptisch: das Wissen
zu Biopharmazeutika fehlt
– www.biosimilars.de: Informationen zu Herstellung, Qualität und
Sicherheit von Biosimilars
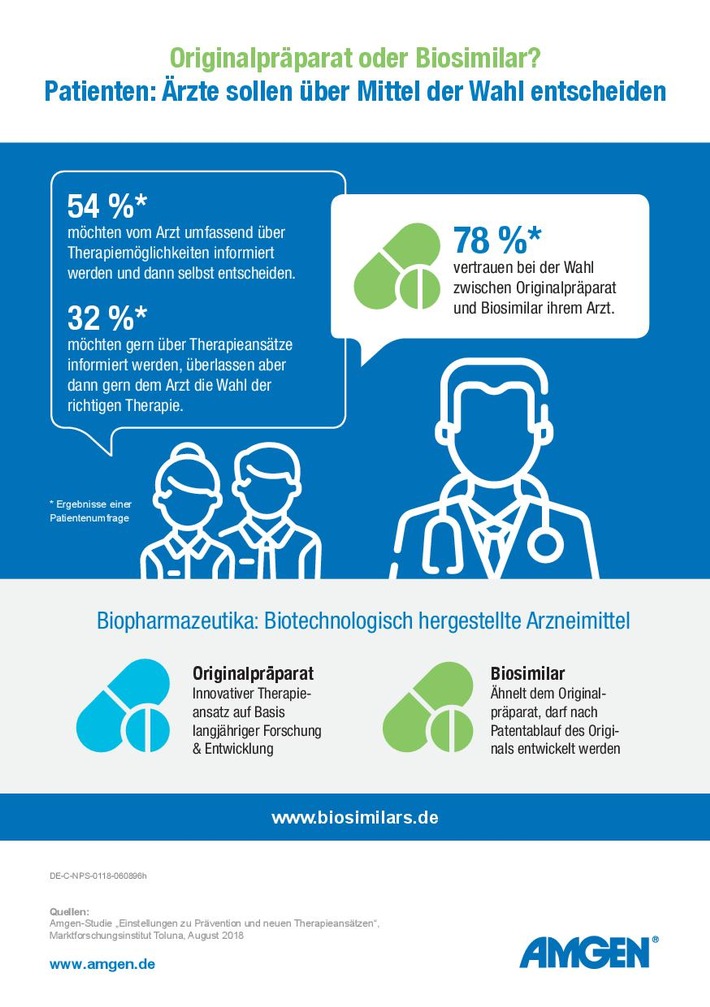
83 Prozent der Deutschen sehen in Biosimilars eine Chance für das
Gesundheitssystem: Sie erwarten geringere Arzneimittelkosten sowie
einen breiteren Einsatz von innovativen Therapien.(1) Bei der
Therapieentscheidung – ob Originalpräparat oder Biosimilar – sind
acht von zehn Deutschen jedoch überfordert und vertrauen ihrem
Arzt.(1) Das sind Ergebnisse einer Umfrage des
Biotechnologie-Unternehmens Amgen, in der 1.000 Deutsche
repräsentativ zu Prävention und innovativen Therapien befragt wurden.
Biosimilars sind biologisch hergestellte Arzneimittel, die dem
Originalpräparat ähneln und nach Ablauf des Patentschutzes des
Originals entwickelt werden dürfen. Sie sind hinsichtlich ihrer
Wirkung und Verträglichkeit gleichwertig mit den entsprechenden
Originalprodukten. 34 Biosimilars sind heute in Europa zugelassen.
(2) Allein im Jahr 2017 kamen zehn neue biotechnologische
Nachahmerprodukte hinzu, so die Zahlen des vfa bio, der
Interessengruppe Biotechnologie im Verband der forschenden
Pharma-Unternehmen. (3)
Skepsis bei Verbrauchern: Aufklärung zu Biopharmazeutika notwendig
Obwohl die Teilnehmer der Amgen-Umfrage in Biosimilars ein großes
Potenzial erkennen, überwiegt die Skepsis: Mehr Nebenwirkungen und
eine geringere Verträglichkeit bei Biosimilars befürchten fast 40
Prozent der Befragten.(1) Mehr als die Hälfte der Deutschen – 61
Prozent – bevorzugt das Originalpräparat.(1) Oftmals (63 Prozent)
werden Nachahmerprodukte als vertrauenswürdiger bewertet, wenn das
Pharmaunternehmen auch Originalpräparate herstellt.(1) „Die Umfrage
zeigt einen großen Informationsbedarf bei Verbrauchern auf“, sagt Dr.
Roman Stampfli, Geschäftsführer der Amgen GmbH. „Sie sind offen
gegenüber innovativen Therapiemöglichkeiten, aber es fehlen ihnen die
Kenntnisse zu Biopharmazeutika – sowohl zu Originalpräparaten als
auch zu Biosimilars. Mit unseren Website-Angeboten wie
www.biosimilars.de wollen wir umfangreiches Wissen für biologisch
hergestellte Arzneimittel vermitteln und die Akzeptanz steigern.“
Therapieentscheidung: Arzt ist der zentrale Ratgeber
Grundsätzlich sind die Deutschen gegenüber medizinischen
Innovationen aufgeschlossen. Jeder Zweite zieht bei einer schweren
Krankheit innovative Arzneimittel altbewährten Medikamenten vor. (1)
Aber auch bei leichten Erkrankungen setzen viele (36 Prozent) auf
neue Therapieansätze. (1) Hier ist der Arzt als wichtiger Berater
gefragt: Mehr als jeder zweite Deutsche möchte von seinem Arzt
umfassend über unterschiedliche Therapiemöglichkeiten informiert
werden, die Wahl der richtigen Therapie aber selbst übernehmen. (1)
Nur 36 Prozent überlassen diese Wahl ihrem Arzt (1). „Die
Entscheidung, ob der Patient das Biosimilar oder das Originalpräparat
erhält, liegt selbstverständlich beim Arzt. Denn er allein ist der
Experte für die Therapieentscheidung“, stellt der
Amgen-Geschäftsführer klar.
Zur Studie
Für die Studie „Einstellungen zu Prävention und neuen
Therapieansätzen“ wurden 1.000 Deutsche im Auftrag des
Biotechnologie-Unternehmens Amgen repräsentativ zu Prävention und
neuen Therapiemöglichkeiten, zu Forschung und medizinischem
Fortschritt befragt. Die Befragung führte das Marktforschungsinstitut
Toluna im August 2018 online durch.
Über Amgen
Amgen ist ein weltweit führendes unabhängiges
Biotechnologie-Unternehmen, das mit nahezu 20.000 Mitarbeitern in
fast 100 Ländern weltweit seit fast 40 Jahren vertreten ist. In
Deutschland arbeiten wir an drei Standorten mit über 700 Mitarbeitern
jeden Tag daran, Patienten zu helfen. Weltweit profitieren jährlich
Millionen von Patienten mit schweren oder seltenen Erkrankungen von
unseren Therapien. Unsere Arzneimittel werden in der Nephrologie,
Kardiologie, Hämatologie, Onkologie, Knochengesundheit und bei
chronisch-entzündlichen Erkrankungen eingesetzt. Wir verfügen über
eine vielfältige Pipeline und haben kürzlich Biosimilars mit in unser
Portfolio aufgenommen. www.amgen.de
Referenzen
1. Amgen-Studie „Einstellungen zu Prävention und neuen
Therapieansätzen“, Marktforschungsinstitut Toluna, August 2018
2. http://ots.de/dwBVR3, letzter Abruf: Oktober 2018
3. Biotech-Report „Medizinische Biotechnologie in Deutschland
2018″, Boston Consulting Group, vfa bio – Verband Forschender
Arzneimittelhersteller e.V.
Zukunftsgerichtete Aussagen
Dieses Dokument enthält zukunftsgerichtete Aussagen, die auf den
aktuellen Erwartungen und Einschätzungen von Amgen basieren. Alle
Aussagen, mit Ausnahme von Aussagen über Fakten aus der
Vergangenheit, sind zukunftsgerichtete Aussagen. Dies gilt auch für
Aussagen über Ertragsprognosen, Betriebsergebnismargen,
Investitionsaufwendungen, liquide Mittel oder andere
Finanzkennzahlen, erwartete gerichtliche, schiedsgerichtliche,
politische, regulatorische oder klinische Ergebnisse oder Praktiken,
Verhaltensmuster von Kunden und Verschreibern,
Entschädigungsaktivitäten und -ergebnisse sowie andere ähnliche
Prognosen und Ergebnisse.
Zukunftsgerichtete Aussagen sind mit beträchtlichen Risiken und
Unwägbarkeiten behaftet, einschließlich der nachfolgend genannten und
in den von Amgen eingereichten Security and Exchange
Commission-Berichten näher beschriebenen. Dazu gehört auch unser
jüngster Jahresbericht auf dem Formblatt 10-K sowie nachfolgende
Periodenberichte auf den Formblättern 10-Q und Form 8-K. Sofern
nichts anderes angegeben ist, trifft Amgen diese Aussagen zum
vermerkten Datum und verpflichtet sich nicht dazu, in diesem Dokument
enthaltene zukunftsgerichtete Aussagen zu aktualisieren, wenn neue
Informationen vorliegen, Ereignisse eintreten oder aufgrund anderer
Gründe.
Für zukunftsgerichtete Aussagen kann keine Garantie übernommen
werden und tatsächliche Ergebnisse können von den erwarteten
abweichen. Unsere Ergebnisse werden dadurch beeinflusst, wie
erfolgreich wir neue und bestehende Produkte im In- und Ausland
vermarkten. Sie hängen von klinischen und regulatorischen
Entwicklungen ab, die aktuelle und zukünftige Produkte betreffen, von
der Umsatzsteigerung bei kürzlich eingeführten Produkten, vom
Wettbewerb mit anderen Produkten (einschließlich Biosimilars), von
Problemen oder Verzögerungen bei der Herstellung unserer Produkte
sowie von globalen Wirtschaftsbedingungen. Darüber hinaus wird der
Vertrieb unserer Produkte vom Preisdruck, der Wahrnehmung in der
Politik und der Öffentlichkeit und von den Erstattungsrichtlinien der
privaten und gesetzlichen Krankenkassen sowie Behörden und Managed
Care Provider beeinflusst und kann zudem von Entwicklungen bei
gesetzlichen Bestimmungen, klinischen Studien und Richtlinien sowie
nationalen und internationalen Trends zur Eindämmung von Kosten im
Gesundheitswesen beeinflusst werden. Überdies unterliegen unsere
Forschungs- und Testarbeit, unsere Preisbildung, unser Marketing und
andere Tätigkeiten einer starken Regulierung durch in- und
ausländische staatliche Aufsichtsbehörden. Wir oder andere könnten
nach der Markteinführung unserer Produkte Sicherheits- oder
Herstellungsprobleme oder Nebenwirkungen feststellen. Unser
Unternehmen könnte von behördlichen Untersuchungen,
Rechtsstreitigkeiten und Produkthaftungsklagen betroffen sein.
Darüber hinaus könnte unser Unternehmen von neuen Steuergesetzen
betroffen sein, die zu erhöhten Steuerverbindlichkeiten führen. Für
den Fall, dass wir unseren Verpflichtungen aus der mit den
US-Regierungsbehörden geschlossenen Vereinbarung zur
Unternehmensintegrität nicht nachkommen, drohen beträchtliche
Sanktionen. Außerdem könnte der Schutz der für unsere Produkte und
unsere Technologie angemeldeten und erteilten Patente von unseren
Mitbewerbern angegriffen, außer Kraft gesetzt oder unterlaufen
werden. Zudem könnten wir in aktuellen oder zukünftigen
Rechtsstreitigkeiten unterliegen. Wir führen einen Großteil unserer
kommerziellen Fertigung in wenigen Schlüsselbetrieben durch und sind
darüber hinaus bei unseren Herstellungsaktivitäten teilweise von
Dritten abhängig. Lieferengpässe können den Vertrieb bestimmter
aktueller Produkte und die Entwicklung von Produktkandidaten
beschränken. Zudem stehen wir bei vielen der von uns vermarkteten
Produkte sowie in Bezug auf die Entdeckung und Entwicklung neuer
Produkte in Konkurrenz zu anderen Unternehmen. Die Entdeckung oder
Identifizierung neuer Produktkandidaten kann nicht garantiert werden,
und der Schritt vom Konzept zum Produkt ist nicht gesichert. Daher
kann nicht dafür garantiert werden, dass ein bestimmter
Produktkandidat erfolgreich sein und vermarktet werden wird. Des
Weiteren werden manche Rohstoffe, Medizinprodukte und Komponenten für
unsere Produkte ausschließlich von Drittanbietern geliefert. Die
Entdeckung signifikanter Probleme mit einem Produkt, das einem
unserer Produkte ähnelt, kann auf eine gesamte Produktklasse
zurückfallen und den Vertrieb der betreffenden Produkte, unser
Unternehmen und unser Betriebsergebnis stark beeinträchtigen. Die
Akquisition anderer Unternehmen oder Produkte unsererseits sowie
unsere Anstrengungen zur Eingliederung aufgekaufter Betriebe kann
fehlschlagen. Möglicherweise gelingt es uns nicht, Geld zu günstigen
Konditionen am Kapital- und Kreditmarkt aufzunehmen oder überhaupt
Geld aufzunehmen. Wir sind immer stärker von IT-Systemen,
Infrastruktur und Datensicherheit abhängig. Unser Aktienkurs schwankt
und kann von unterschiedlichsten Ereignissen beeinflusst werden.
Unser Geschäftserfolg kann die Zustimmung unseres Verwaltungsrats zur
Ausschüttung einer Dividende sowie unsere Fähigkeit zur Zahlung einer
Dividende oder zum Rückkauf unserer Stammaktien beschränken. Die
wissenschaftlichen Informationen, die in dieser Medianote besprochen
sind, und die in Verbindung zu unseren sich in der klinischen Prüfung
befindlichen Produktkandidaten stehen sind vorläufig und
investigativ. Solche sich in der klinischen Prüfung befindlichen
Produktkandidaten sind nicht von der U.S. Food and Drug
Administration zugelassen und es können keine Rückschlüsse
hinsichtlich Sicherheit und Wirksamkeit der sich in der klinischen
Prüfung befindlichen Produktkandidaten gezogen werden.
DE-C-NPS-0418-064287c
Pressekontakt:
Bettina Jödicke-Braas,
E-Mail: communication@amgen.de,
Telefon: 089-149096-1627
Original-Content von: Amgen GmbH, übermittelt durch news aktuell