Als Hersteller verschiedener Feuchtemesssysteme im Bereich Prozessmesstechnik bieten wir Ihnen die optimale Lösung für Ihre Anwendungen…
Continue ReadingKategorie: Biotechnologie

BioPark Geschäftsbericht 2022
Die aktuelle Entwicklung der Life Science Firmen in der BioRegio Regensburg zeigt in der Ära nach…
Continue ReadingBioEcho erhält Patent für seine EchoLUTION-Technologie in den USA und Japan
BioEcho erhält ein Patent für die innovative EchoLUTION-Technologie, die etablierte Verfahren zur Nukleinsäure-Extraktion ablöst.
Continue Reading
Valentins-Date mit Bioökonomie-Start-ups
Wettbewerb PlanB kürt Preisträger – Bioenergie-Start-up Reverion aus Eresing Sieger
Continue Reading
Organ-on-Chip Akademie
Biotech-Unternehmen Dynamic42 gibt Expertise zur Zukunftstechnologie Organ-on-Chip weiter
Continue ReadingKühl- und Gefrierschränke für Labor und Pharmaindustrie !
Die Angelantoni X-COLD-Serie ist eine Serie von Kühl- und Gefrierschränken für die Langzeitkonservierung von biologischen Proben…
Continue Reading
Jobst Technologies feiert 20jähriges Bestehen
Mut, Kreativität, Hingabe und vor allem eine Vision sind die wichtigsten Voraussetzungen für ein erfolgreiches Technologieunternehmen:…
Continue Reading
BioEcho bringt EchoLUTION™ Cell Culture RNA Kit auf den Markt
Das Kölner Biotechnologie-Unternehmen BioEcho Life Sciences führt das EchoLUTION Cell Culture RNA Kit ein, das eine…
Continue ReadingAufbruch zu mehr Bioökonomie im Donauraum
Nach seinem erfolgreichen Abschluss blickt das Projekt „GoDanuBio“ auf zweieinhalb Jahre Projektzeitraum zurück und präsentiert seine…
Continue Reading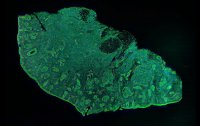
Bessere Ergebnisse bei Hautkrebsoperationen
Fluoreszenzbildgebung verhilft zu besseren Ergebnissen bei der Behandlung von Hautkrebs im Kopf- und Halsbereich
Continue Reading
DORUCON führt Freiburger Start-Up Actome zum europäischen Förder-Jackpot
Mit Hilfe der Unternehmensberatung DORUCON konnte das Life-Science-Start-Up Actome im EIC Accelerator, dem europäischen Förderprogramm für…
Continue Reading
